Se le llama gas al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.
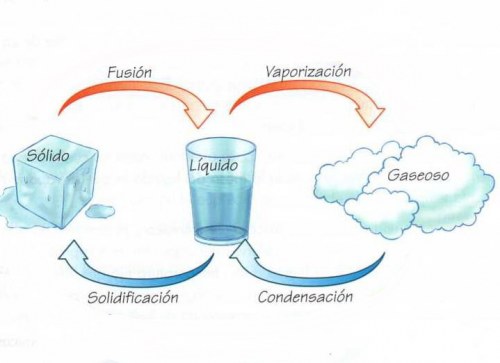
Y estos son los estados :
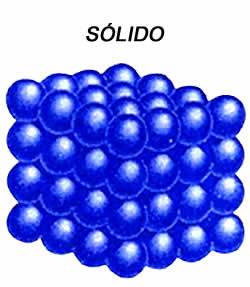
Los objetos en estado sólido se presentan como cuerpos de forma definida; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros así como resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión. En los sólidos cristalinos, la presencia de espacios interarticulares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las siguientes características:
- Cohesión elevada.
- Tienen una forma definida y memoria de forma, presentando fuerzas elásticas restitutivas si se deforman fuera de su configuración original.
- A efectos prácticos son incompresibles.
- Resistencia a la fragmentación.
- Fluidez muy baja o nula.
- Algunos de ellos se subliman.
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos.
El estado líquido presenta las siguientes características:
- Cohesión menor.
- Poseen movimiento de energía cinética.
- Son fluidos, no poseen forma definida, ni memoria de forma por lo que toman la forma de la superficie o el recipiente que lo contiene.
- En el frío se contrae (exceptuando el agua).
- Posee fluidez a través de pequeños orificios.
- Puede presentar difusión.
- Son poco compresibles.
Se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción, lo que hace que los gases no tengan volumen y forma definida, y se expandan libremente hasta llenar el recipiente que los contiene. Su densidad es mucho menor que la de los líquidos y sólidos, y las fuerzas gravitatorias y de atracción entre sus moléculas resultan insignificantes. En algunos diccionarios el término gas es considerado como sinónimo de vapor, aunque no hay que confundir sus conceptos: vapor se refiere estrictamente a aquel gas que se puede condensar por presurización a temperatura constante.
El estado gaseoso presenta las siguientes características:
- Cohesión casi nula.
- No tienen forma definida.
- Su volumen es variable.
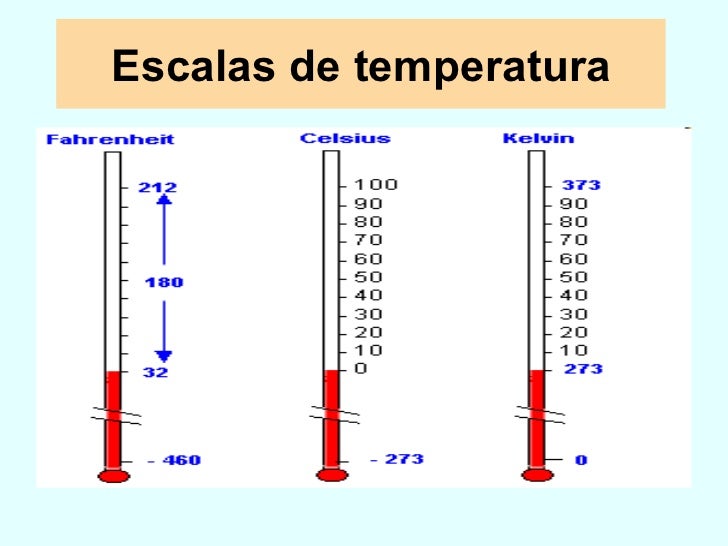
TEMPERATURA:
La temperatura es una magnitud referida a las nociones comunes de calor medible mediante un termómetro. En física, se define como una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como «energía cinética», que es la energía asociada a los movimientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones.
Hay varias escalas para medir el gas entre esas estan :
- Fahrenheit
- Celcius
- Kelvin
PRESIÓN:
La presión (símbolo p)1 2 es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie, y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea. En el Sistema Internacional de Unidades la presión se mide en una unidad derivada que se denomina pascal (Pa) que es equivalente a una fuerza total de un newton (N) actuando uniformemente en un metro cuadrado (m²). En el Sistema Inglés la presión se mide en libra por pulgada cuadrada que es equivalente a una fuerza total de una libra actuando en una pulgada cuadrada.
VOLUMEN:
El volumen1 es una magnitud métrica de tipo escalar2 definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, el ancho y la altura. Matemáticamente el volumen es definible no sólo en cualquier espacio euclídeo, sino también en otro tipo de espacios métricos que incluyen por ejemplo a las variedades de Riemann.
LEYES...
- Volúmenes iguales de dos gases en las mismas condiciones de temperatura y presión poseen el mismo número de moléculas. Esa ley fue el origen del concepto de molécula está implícita en el concepto de volumen molar (CNTP), pues 22,4 litros de cualquier gas poseen 6,02 x 1023 moléculas
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientementedel elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Por lo tanto: V1 / n1 = V2 / n2
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen


La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión: 
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Además se obtiene despejada que:
Donde:
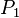 = Presión Inicial
= Presión Inicial
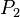 = Presión Final
= Presión Final
 = Volumen Inicial
= Volumen Inicial
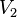 = Volumen Final
= Volumen Final
La ley de Charles es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.



La ley de Gay-Lussac1 establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
- Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (kelvin) permanece constante:

o también:

donde:
- P es la presión
- T es la temperatura absoluta (es decir, medida en kelvin)
- k3 una constante de proporcionalidad
LABORATORIO






















 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.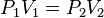




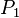 = Presión Inicial
= Presión Inicial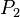 = Presión Final
= Presión Final = Volumen Inicial
= Volumen Inicial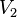 = Volumen Final
= Volumen Final












